Objectifs:
- Connaître le vocabulaire
- Identifier les formes des énergies mises en jeu dans une chaîne de transformations d’énergies
- Pour un transformateur d’énergie donné ou observé :
- identifier les formes des énergies consommées, utiles et perdues;
- tracer son schéma énergétique.
- Connaître la définition
- du rendement énergétique
- de la puissance
- Connaître les unités usuelles
- de l’énergie et leurs conversions
- de la puissance et leurs conversions
- Savoir calculer
- un rendement énergétique
- une puissance
- Déterminer expérimentalement la puissance d’un appareil électrique.
- Savoir calculer l’énergie thermique liée à une variation de la température.
- Connaître la définition de la chaleur massique.
- Déterminer expérimentalement et/ou par calcul :
- une puissance thermique;
- le rendement d’un appareil électrique qui produit de l’eau chaude;
- la chaleur massique d’une matière.
- Établir un bilan pour des échanges d’énergie qui se font dans un calorimètre;
- Mesurer les masses et les températures utiles au calcul des énergies du bilan.
- Utiliser le bilan pour calculer:
- une température
- une masse
- une chaleur massique
- Savoir calculer ou déterminer expérimentalement la capacité calorifique d’un calorimètre
- Savoir calculer l’énergie chimique liée à la combustion d’un combustible.
- Connaître la définition du pouvoir énergétique (ou calorifique) d’un combustible.
- Déterminer expérimentalement et/ou par calcul :
- le rendement d’un réchaud à combustible
- le pouvoir énergétique d’un combustible
- Savoir calculer l’énergie nécessaire pour faire
- fondre une masse de glace
- solidifier une masse d’eau
- vaporiser une masse d’eau
- liquéfier une masse de gaz
- Savoir résoudre des problèmes d’équilibre entre différentes matières à des températures différentes et dans des états différents; savoir caractériser l’état d’équilibre
Théorie:
Puissance
La plupart des transformations d’énergie s’opèrent au cours du temps. Par exemple, le carburant d’une voiture se consomme petit à petit pour fournir au véhicule de l’énergie mécanique. L’énergie cinétique d’un objet lancé sur un plan horizontal se transforme petit à petit en énergie thermique, par les frottements.
Supposons que pendant un intervalle de temps t, une énergie E soit transformée. Le rapport de l’énergie au temps définit la puissance moyenne :
- P : puissance en [W] (Watt)
- E : variation d’énergie en [J]
- t : temps en [s]
Les chaînes énergétiques et le rendement énergétique
Lorsqu’on transforme une énergie en une autre, il arrive souvent qu’il apparaisse de l’énergie sous une troisième forme. Par exemple, le moteur de trolleybus transforme de l’énergie électrique en énergie mécanique. Mais le passage du courant électrique dans les bobinages du moteur et les frottements sur les parties mobiles amènent une perte d’énergie sous forme de chaleur (énergie thermique). L’énergie électrique consommée par le moteur se transforme donc en énergie mécanique et en chaleur. Relativement au but que le moteur doit atteindre, les deux formes d’énergie obtenues peuvent être qualifiées d’énergie utile et d’énergie perdue.
D’après le principe général de conservation de l’énergie
- Ec : énergie consommée en [J]
- Eu : énergie utile en [J]
- Ep : énergie perdue en [J]
Il est certain que l’énergie consommée par une machine quelconque est toujours égale à la somme de l’énergie utile et de l’énergie perdue (pour autant qu’il ne s’agisse pas d’une machine capable d’emmagasiner de l’énergie, pour la libérer à un autre moment !). Le rapport de l’énergie utile à l’énergie consommée exprime la qualité de la transformation. On lui donne le nom de rendement et on le désigne par η
- η : rendement énergétique
- Eu : énergie utile en [J]
- Ec : énergie consommée en [J]
Ce rapport peut varier de 0 à 1.
Remarque : le rendement est aussi donné par le rapport de la puissance utile à la puissance consommée
L’énergie thermique
L’énergie thermique (souvent nommée « chaleur ») nécessaire pour élever de ΔT la température d’un corps dépend de la masse de ce corps et de sa nature:
- Eth : énergie thermique s’exprime en Joule (J)
- m : masse du corps en kilogramme (kg)
- ΔT = T2 – T1 : variation de température en degré (°C)
- c : chaleur massique de la matière en (J/kg °C)
La chaleur massique, que l’on appelle parfois aussi capacité thermique massique est déterminée par la quantité d’énergie à apporter par échange thermique pour élever d’un degré la température de un kilogramme de matière.
La capacité calorifique
On appelle capacité calorifique μ la quantité m x c. Elle s’exprime en (J/°C).
- Eth : énergie thermique s’exprime en Joule (J)
- μ : capacité calorifique en (J/°C)
- ΔT = T2 – T1 : variation de température en degré (°C)
Pouvoir énergétique
On appelle pouvoir énergétique H d’un combustible l’énergie thermique libérée par la combustion d’un kilogramme de ce combustible.
- Eth : énergie chimique s’exprime en Joule (J)
- m : masse du corps en kilogramme (kg)
- H : pouvoir énergétique en (J/kg)
Calorimétrie
Lorsque deux corps, à des températures différentes, sont mis en contact, on observe un transfert spontané d’énergie thermique du corps chaud vers le corps froid jusqu’à ce qu’ils atteignent la même température. On dit alors qu’ils sont en équilibre thermique.
Changement d’état
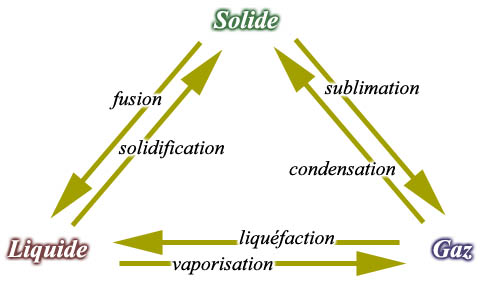
Toute matière a un, deux ou trois états possibles dépendant de sa température: solide, liquide ou gazeux.
Les changements d’états se font, pour les corps purs, à des températures fixes et caractéristiques des corps qui subissent ces transformations. Elles impliquent des apports ou des restitutions d’énergie. Au cours de ces changements d’état, la température du corps ne varie pas. Dans les cas d’un changement inverse, la même quantité d’énergie est restituée.
Fusion :
le passage de l’état solide à l’état liquide s’appelle la fusion; le passage inverse s’appelle la solidification (ou dans certains cas la cristallisation). On nomme chaleur latente de fusion (Lf) la quantité d’énergie nécessaire pour faire passer de l’état solide à l’état liquide une unité de masse d’un corps pur.
- Eth : énergie thermique s’exprime en Joule (J)
- m : masse en kilogramme (kg)
- Lf : chaleur latente de fusion en (J/kg)
Vaporisation:
le passage de l’état liquide à l’état gazeux s’appelle la vaporisation; le passage inverse s’appelle la liquéfaction. On nomme chaleur latente de vaporisation (Lv) la quantité d’énergie nécessaire pour faire passer de l’état liquide à l’état gazeux une unité de masse d’un corps pur.
- Eth : énergie thermique s’exprime en Joule (J)
- m : masse en kilogramme (kg)
- Lv : chaleur latente de fusion en (J/kg)
Exercices faits en classe :
- TE 05, 11, 12, 13, 15, 16
- EP 51, 52, (53), (54), 55, (56), (57), (58), (59), (60), (61), (62), (63), (64), 65, 66, 67, (68), (69), (70), 71, (72), (73), 74, (75), 76, (77), (78), (79), 80, 81, 82, 83, 84, (85), (86), 87
- CA 141, 143, 144, 146, 147, 148, (149), 153, (154), 155, (161), 163, 164, 165, (166), 167, (168), (169), (170), (171)
- CA (172), (173), 174, (175), (176), (177), (178), (179), 180, (181), (182), 183, 184, (185), (186), (187), (188), (189), 190, 191, (192), (193), (194), (195), (196), (197), (198), 199, (200), (201), 202, (203), (204), (205), (206), (207), (208)
Exercices distribués en classe :
TP :
- TP 1 (+ corrigé) (détermination de la chaleur massique d’un liquide en utilisant un réchaud à alcool)
- TP 2 (+ corrigé) (détermination de la chaleur massique d’un liquide en utilisant un thermoplongeur)
- TP 3 (+ corrigé) (détermination de la masse de combustible utilisée par un réchaud sans avoir de balance)
- TP 4 (+ corrigé) (détermination de la chaleur latente de fusion de la glace)
- TP 5 (+ corrigé) (détermination de la chaleur latente de vaporisation de l’eau)
Exercices supplémentaires :
- énergie thermique : série 1
- énergie chimique : série 1
- puissance et rendement : série 1
- calorimétrie : série 1
Prétest: